检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2019年7月15日,js3845金沙线路魏文胜课题组以长文形式在Nature Biotechnology杂志在线发表了题为 “Programmable RNA editing by recruiting endogenous ADAR using engineered RNAs” 的研究论文,首次报道了名为LEAPER的新型RNA 单碱基编辑技术。与传统的核酸编辑技术需要向细胞同时递送编辑酶(如Cas蛋白)及向导RNA不同,LEAPER系统仅需要在细胞中表达向导RNA即可招募细胞内源脱氨酶实现靶向目标RNA的编辑。利用该技术,研究人员在一系列疾病相关基因转录本中实现了高效、精准的编辑,并成功修复了来源于Hurler综合征病人的α-L-艾杜糖醛酸酶缺陷细胞。该技术的建立为生命科学基础研究和疾病治疗提供了一种全新的工具。
近年来,以CRISPR/Cas9为代表的基因组编辑技术在生物医学等诸多领域产生了深远的影响,但该技术目前存在的一系列问题使其在临床治疗应用中遭遇瓶颈。问题的根源之一在于当前的基因编辑体系依赖于外源编辑酶或效应蛋白的表达,从而造成 (1) 蛋白分子量过大使得通过病毒载体进行装载及人体内递送十分困难;(2) 由蛋白过表达引起的DNA/RNA水平的脱靶效应;(3) 由外源蛋白表达引起的机体免疫反应及损伤;(4) 机体内的预存抗体使外源编辑酶或效应蛋白被中和从而导致基因编辑失败等。为解决上述问题,亟需建立新型基因编辑工具,特别是摆脱传统技术依赖于外源蛋白表达的桎梏。
ADAR (Adenosine deaminase acting on RNA) 是一类在人体内各组织中广泛表达的腺苷脱氨酶,能够催化RNA分子中腺苷A→肌苷I(鸟苷G)的转换。相比DNA编辑,RNA编辑不需要对基因组序列进行永久性改变,这种可逆的、易于调控的编辑方式在安全性上可能更具优势。麻省理工学院张锋课题组曾报道,过表达Cas13-ADAR融合蛋白及向导RNA可以实现靶向目标RNA的精准编辑 (Science 2017),但是该方法无法解决外源蛋白表达造成的问题。魏文胜课题组在研究中首次发现,只需转入一条特殊设计的RNA (arRNA, ADAR-recruiting RNA),就能够通过招募细胞内源的ADAR1 蛋白对靶向基因转录本上特定的腺苷产生高效精准的编辑,并不需要引入任何外源效应蛋白。ADAR1基因敲除与回补实验和高通量测序分析表明,细胞内源的ADAR1 蛋白介导了这一过程(图一)。这种新型RNA编辑技术被命名为LEAPER (Leveraging Endogenous ADAR for Programmable Editing on RNA)。
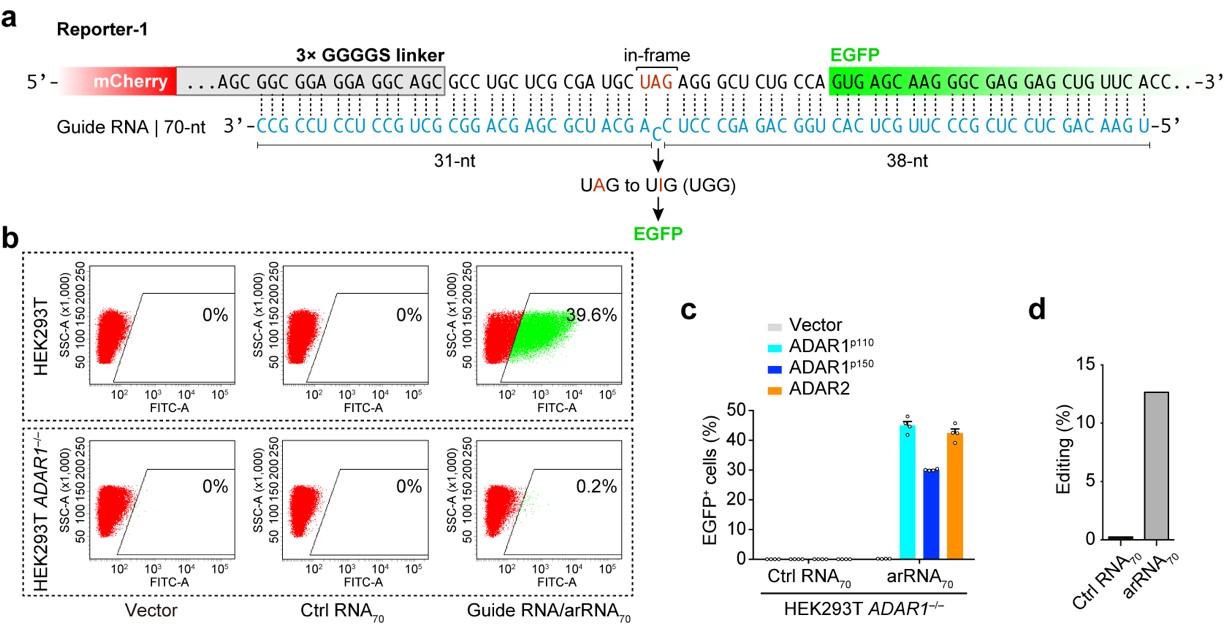
图一、 利用细胞内源ADAR1 蛋白实现精准的RNA编辑。
深入研究表明LEAPER具有广泛的适用性,能对RNA分子上绝大多数的腺苷酸位点进行精准编辑。在人的原代细胞-包括肺成纤维细胞、支气管上皮细胞及T细胞中,LEAPER的编辑效率最高可达80%,显示出该技术在疾病治疗中巨大的应用前景。在诸多应用尝试中,LEAPER的高效、精准的特性得到充分验证。比如LEAPER可以通过修复抑癌基因TP53中的致病突变来恢复p53突变体的转录调节功能。此外,在Hurler综合征患者来源的原代细胞中,LEAPER能够成功修复致病突变,并恢复细胞中的α-L-艾杜糖醛酸酶的催化活性(图二)。
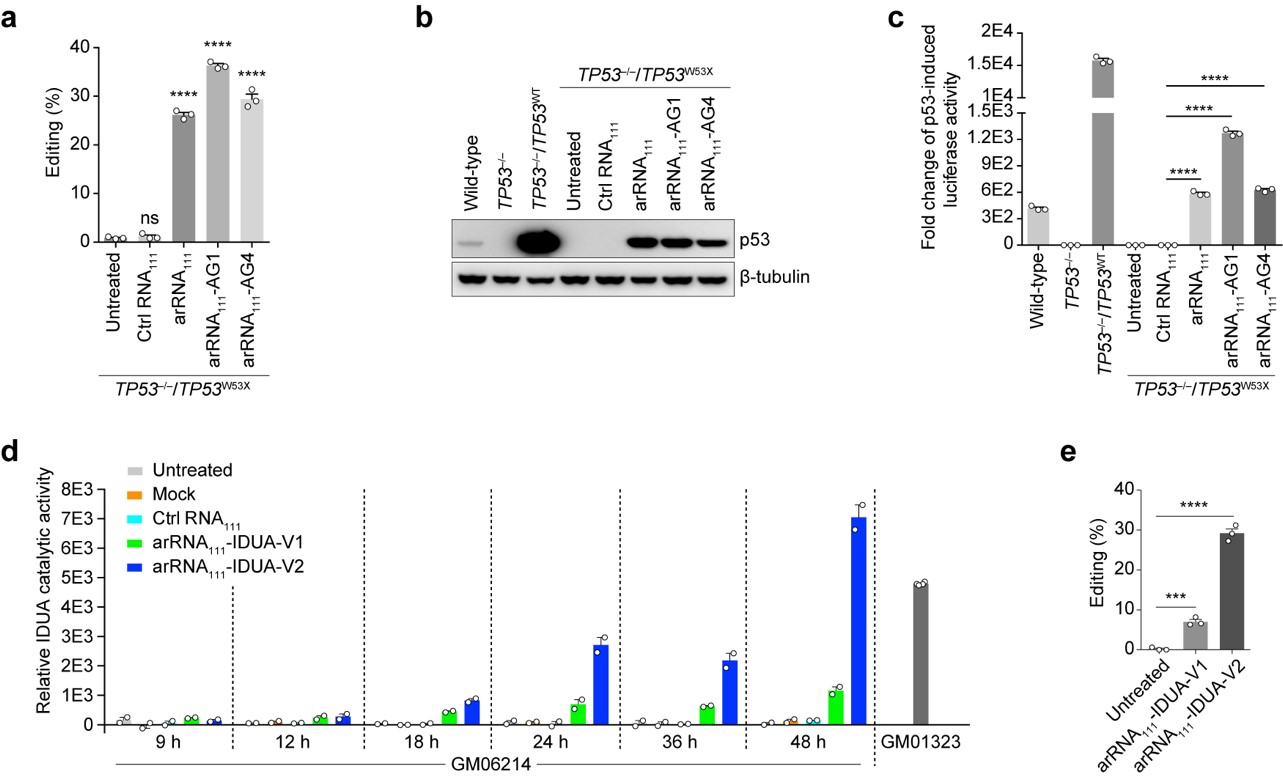
图二、 LEAPER修复 p53突变体的转录调节功能和 α-L-艾杜糖醛酸酶的催化活性。
近期的研究表明,DNA单碱基编辑技术,包括胞嘧啶碱基编辑器和腺嘌呤碱基编辑器在RNA或DNA水平上产生了严重的脱靶现象 (Science 2019; Nature 2019),引发人们对其安全性的担忧。利用RNA-Seq技术在转录组水平对LEAPER技术进行的评估,没有观测到明显的脱靶现象,显示了新技术的高度特异性。另外,LEAPER不影响内源ADAR蛋白的正常功能,也不会激活细胞中的天然免疫反应,表明其是一类安全的基因编辑工具。
与RNAi类似,LEAPER充分利用了细胞中天然存在的机制:仅用一条RNA 就实现了精确高效的RNA单碱基编辑,从而避免了任何由于表达外源效应蛋白而引起的各种潜在问题。这种新型的基因编辑技术在科学研究和疾病治疗中显示出可观的优势与潜能,同时也为发展基于细胞内源机制的基因编辑技术指明了方向。近期,Thorsten Stafforst课题组报道了命名为RESTORE (recruiting endogenous ADAR to specific transcripts for oligonucleotide-mediated RNA editing) 的RNA编辑方法 (Nature Biotechnology 2019)。与LEAPER类似,RESTORE也能够利用内源ADAR进行靶向RNA的精准编辑;不同之处在于,RESTORE中的向导RNA是一段化学合成的寡核苷酸,为保持其稳定性,需要进行大量化学修饰。而LEAPER可以通过稳定表达的方式在细胞内发挥作用,因此适用于装载至腺相关病毒 (AAV)、慢病毒等载体中,在递送至机体后持续发挥功能。
北京大学魏文胜课题组博士生璩良 (PTN)、伊宗裔 (CLS)、王春慧 (BIOPIC)、曹中正 (CLS)、博士后朱诗优、副研究员周卓博士和博雅辑因生物科技有限公司袁鹏飞博士为该论文共同第一作者,魏文胜为该论文通讯作者。该研究项目得到了国家自然科学基金重点及面上项目、北京市科委生命科学前沿创新培育项目、北京未来基因诊断高精尖创新中心、北大-清华生命科学联合中心以及传染病防治国家科技重大专项的基金支持。