检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2020年5月12日,js3845金沙线路、北大清华生命科学联合中心肖俊宇研究组在Cell Research杂志在线发表题为“Structural insights into secretory immunoglobulin A and its interaction with a pneumococcal adhesin”的研究论文,报道人源分泌型免疫球蛋白A复合体、及其与肺炎链球菌黏附素SpsA的高分辨率冷冻电镜结构。
黏膜覆盖了人体消化系统、呼吸系统及泌尿生殖系统中的多数内脏器官,是机体抵抗病原体感染的第一道屏障。成年人体内的黏膜面积可达400 m2。免疫球蛋白A(IgA)是黏膜免疫系统中最主要的抗体成分、也是人体每天产生最多的抗体。浆细胞生成的IgA分子经过胞移作用穿过黏膜上皮细胞到达黏膜表面,成为分泌型免疫球蛋白A(SIgA)。与血清中的单体IgA不同,黏膜中的SIgA主要以二聚体的形式存在,其中两个IgA分子由J链(J-chain)介导相连。此外,SIgA中还存在一个关键蛋白:分泌组分(secretory component, SC)。SC是多聚免疫球蛋白受体pIgR的胞外域。pIgR负责将含有J链的IgA分子转运穿越黏膜上皮细胞,然后由蛋白酶切割形成SC并与IgA共同分泌。
由于SIgA在黏膜免疫防御系统中的重要作用,许多致病菌演化出破坏其功能的机制。肺炎链球菌(Streptococcus pneumoniae)是一种革兰氏阳性菌,能够引起中耳炎、肺炎、脑膜炎等疾病。肺炎链球菌黏附素SpsA(S. pneumoniae SIgA binding protein, 也被称为CbpA、PspC)能够结合SIgA而影响其对细菌的清除功能。SpsA也可以结合游离的pIgR/SC,这种结合可能会增强细菌的粘附性,并帮助其入侵细胞。SpsA如何选择性识别人源pIgR/SC还有待研究。
在之前研究中,肖俊宇课题组报道了人源IgM-Fc(Fcm)五聚体/J链/分泌组份三元复合体的冷冻电镜结构(Science, 2020, 367:1014-1017)。在本研究中,作者通过单颗粒冷冻电镜技术解析了人源IgA-Fc(Fca)二聚体/J链/分泌组份复合体整体分辨率3.2 Å的结构。结果显示,SIgA中的两个IgA分子以尾对尾、但不完全线性的方式组装成一个类似于回旋镖形状的二聚体。与Fcμ-J-SC复合体结构相比,本研究中的J链具有更加完整的结构信息,并与Fca二聚体有着更为致密的相互作用而稳定IgA二聚体。同时,J链也介导了Fca与pIgR/SC之间的结合。值得一提的是,J链占据了IgA特异性受体FcaRI/CD89在Fca分子一侧的结合区域,因此与IgA单体相比,SIgA应该与FcaRI/CD89以不同的方式相互作用,暗示IgA单体和SIgA可能会在机体中引起不同的下游免疫反应。
除此之外,本研究还解析了SIgA与肺炎球菌黏附素SpsA蛋白N端结构域(SpsANTD)形成的四元复合体3.3 Å的冷冻电镜结构。SpsANTD主要通过一个YRNYPT六肽基序结合在pIgR/SC 的D3和D4结构域之间,而这一六肽基序在各种肺炎球菌亚型中高度保守。有趣的是,参与结合SpsANTD的氨基酸仅在人源pIgR/SC蛋白中存在,暗示常见的模式动物可能不能完全体现肺炎球菌与人体免疫系统的相互作用。这一工作为SIgA的功能研究奠定了基础,也为肺炎链球菌致病机理的研究提供了重要参考。
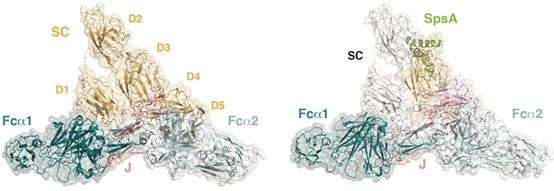
人源Fca-J-SC及其与肺炎链球菌黏附素SpsANTD复合体的冷冻电镜结构
蛋白质与植物基因研究国家重点实验室、js3845金沙线路、北大清华生命科学联合中心肖俊宇研究员为该论文的通讯作者。北京大学生命学院2016级博士研究生王禹心、生命学院电镜平台王国鹏博士和2015级博士研究生(PTN项目)李雅鑫为该论文的共同第一作者。研究得到了国家重点研发计划、国家自然科学基金委、北京大学临床+X项目、js3845金沙线路启东产业创新基金的经费资助。北京大学冷冻电镜平台和高性能计算平台对数据的收集和处理给予了大力支持。