检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
红细胞是人体中数目最多的血细胞,健康人体每天会新生约二十亿个红细胞以替代受损或失去的红细胞,其发育过程的障碍会导致各类贫血疾病的发生,例如先天性纯红再障(DBA)等 [1-3]。理解红细胞发育的动态改变及机制对贫血类疾病的研究和治疗具有极大的基础生物学及转化意义。红细胞来源于造血干细胞,其发育可以被分为两个阶段:具有强大的自我更新能力的红系祖细胞和能够快速分化脱核的红系前体细胞阶段。红系祖细胞和前体细胞这种巨大差异背后的潜在机制一直不甚清楚 [4]。
2023年5月31日js3845金沙线路、北大-清华生命科学联合中心、北京大学血液病研究所李湘盈课题组在Nucleic Acids Research发表题为“Multidimensional profiling reveals GATA1-modulated stage-specific chromatin states and functional associations during human erythropoiesis”的研究论文,该研究系统的解析了人类红系祖细胞和前体细胞包含启动子-增强子相互作用在内的染色质结构信息,首次发现阶段特异性转录因子(ETV6,CEBPA,RUNX1,GATA等)逐步参与了从造血干细胞到红系祖细胞以及前体细胞阶段启动子-增强子相互作用的建立。在整个红系发育过程中,GATA1逐渐主导启动子-增强子相互作用,该研究为理解红细胞发育的时期特异性调控奠定基础,同时为红细胞相关疾病的研究和治疗提供新的思路。
在这项研究中,作者首先使用 Micro-C和 H3K27ac/GATA1 HiChIP,对HSPC、以及采用改进的方法分离的高纯度红系祖细胞和红系前体细胞进行了染色质结构的全面分析,特别是启动子-增强子的相互作用:将这些数据与关键转录因子(ETV6,CEBPA,RUNX1,GATA1/2等)的全基因组动态结合改变以及转录组分析相结合,系统地了解人类红细胞生成的三维基因组特征。整合分析表明,阶段特异性转录因子参与了从HSPC到红系祖细胞再到前体细胞阶段启动子-增强子相互作用的建立。在从红系祖细胞到前体细胞的转变过程中,GATA1在启动子表现出稳定的结合模式,但位于增强子区域的GATA1结合则较为动态,驱动增强子与周围启动子相互作用,从而促进红细胞相关基因在前体细胞阶段大量表达。此外,作者结果表明,GATA1的剂量对于维持红系祖细胞状态至关重要,暂时性的GATA1短缺会促进从红系祖细胞去分化到更早的祖细胞状态,从而拥有更高的自我更新能力。
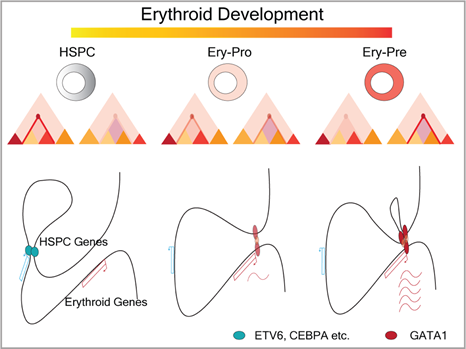
图 1 人类红细胞发育过程中的启动子-增强子相互作用改变:
在从红系祖细胞(Ery-Pro)到前体细胞(Ery-Pre)的分化过程中,红系重要转录因子GATA1在启动子表现出较为稳定结合,位于增强子区域的GATA1结合改变驱动增强子与启动子相互作用,促进红细胞相关基因在前体细胞阶段大量表达。
综上所述,本研究利用多种染色质结构解析及组学技术,不仅提供了对整个人类红细胞分化过程中3D基因调控的全面理解,而且还揭示了阶段特异性转录因子如何参与调节染色质相互作用的形成,特别是动态GATA1结合改变和剂量如何与红细胞基因的逐步基因调控及细胞状态相关联。这些结果可能会进一步促进与红细胞遗传性和后天性疾病相关的广泛研究。
js3845金沙线路、北大-清华生命科学联合中心、北京大学血液病研究所李湘盈研究员为本论文通讯作者。js3845金沙线路博士后李栋为该论文第一作者,js3845金沙线路博士研究生赵欣滢、周硕、扈琪、吴帆也参与了部分工作。
原文链接: https://doi.org/10.1093/nar/gkad468
1. Dzierzak, E. and S. Philipsen, Erythropoiesis: development and differentiation. Cold Spring Harb Perspect Med, 2013. 3(4): p. a011601.
2. Palis, J., Primitive and definitive erythropoiesis in mammals. Front Physiol, 2014. 5: p. 3.
3. Sankaran, V.G. and M.J. Weiss, Anemia: progress in molecular mechanisms and therapies. Nat Med, 2015. 21(3): p. 221-30.
4. Li, H., et al., Rate of Progression through a Continuum of Transit-Amplifying Progenitor Cell States Regulates Blood Cell Production. Dev Cell, 2019. 49(1): p. 118-129 e7.