检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
在生物的进化历程中,性别是最为基本、最为重要的生物特征之一。性别差异广泛存在于人类的发育、生理和疾病发生发展进程中。在非生殖系统的癌症中,男性和女性的发病率比例约为 2∶1,在膀胱癌、食道癌和喉癌等一些癌症中该比例接近甚至高于4∶1,且绝大多数癌症在男性中往往具有更差的预后。与癌症相反,自身免疫性疾病则高发于成年女性,其患者中女性比例高达80%1。性别差异与多种遗传和环境因素之间具有重要关联,其中,雄激素水平的差异一直被认为是导致性别差异的重要因素之一2。然而,“雄激素如何调控性别差异?”仍不清晰,而且疾病诊疗的过程中雄激素水平与性别差异等因素未被足够重视。因此,亟需解析雄激素调控性别差异的分子和细胞基础,探索雄激素对性别差异性疾病的发生发展调控机制。这将对开发新型针对雄激素和性别差异性疾病的诊疗策略具有重要意义。
2024年4月10日,北京大学生物医学前沿创新中心/北大-清华生命科学联合中心/js3845金沙线路白凡教授与中国科学院分子细胞科学卓越创新中心高栋研究员、陈洛南研究员、深圳湾实验室于晨研究员团队合作,在Nature杂志上发表了题为“Sex differences orchestrated by androgens at single-cell resolution”的研究论文。该研究工作系统性地解析了雄激素调控性别差异的分子细胞基础。
为了深入解析雄激素在性别差异中所扮演的角色,研究人员对雄性小鼠分别进行了摘除睾丸的去势手术处理和对照组模拟手术处理,对雌性小鼠分别进行了外源添加雄激素处理和对照组处理。研究人员首先对这四种小鼠的每个器官重量进行了比较,发现泪腺、唾液腺和肾脏的重量在雄鼠中更大且受到雄激素正向调控,而免疫器官胸腺的重量在雌鼠中更大且受到雄激素负向调控。这些数据提示了雄激素在器官大小的稳态维持中扮演着重要角色。为了进一步解析雄激素调控性别差异的分子和细胞基础,研究人员对以上四种小鼠的17个器官分别进行单细胞转录组测序,构建了首张用于系统性研究雄激素功能和性别差异的小鼠多器官单细胞图谱(https://casadbtools.com)(图1)。
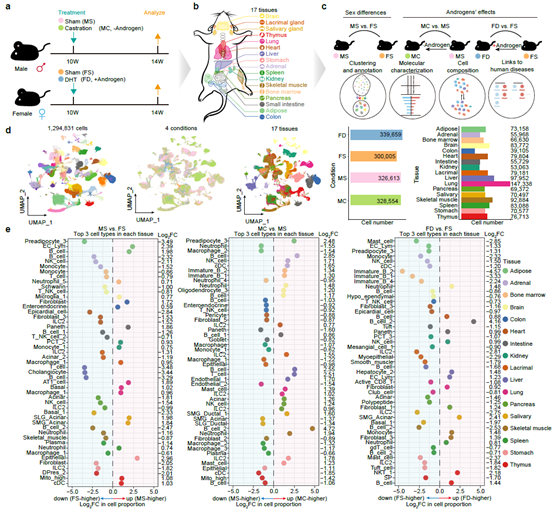
图1. 构建用于系统性研究雄激素功能和性别差异的小鼠多器官单细胞图谱
鉴定雄激素在每种细胞类型中的分子靶点对于理解雄激素塑造性别差异的功能具有重要意义。研究人员对17种器官中的所有细胞类型进行了基因表达分析,发现虽然存在细胞异质性,但是从整体上来看,无论是在雌鼠中添加雄激素还是在雄鼠中去除雄激素均能够显著减弱基因表达上存在的性别差异。研究人员在每种细胞类型中定义了其表达水平受雄激素调控且具有性别差异的基因(androgen-associated sex-biased DEG,AASB-DEG),比如在脂肪组织的脂肪细胞中,Fasn高表达于雌鼠中,对雌鼠添加雄激素则显著降低该基因表达,对雄鼠去除雄激素则显著促进该基因表达。研究人员在AASB-DEG中鉴定到了Egfr、Fos 和 Fosb等增殖分化调控因子,以及Ccl3、Il33和 Ccl4等免疫调控因子。值得注意的是,靶向雄激素信号通路的多种抑制剂已经广泛应用于前列腺癌临床治疗,因此这些AASB-DEG具有直接作为治疗性别差异性疾病关键靶点的潜能(图2)。
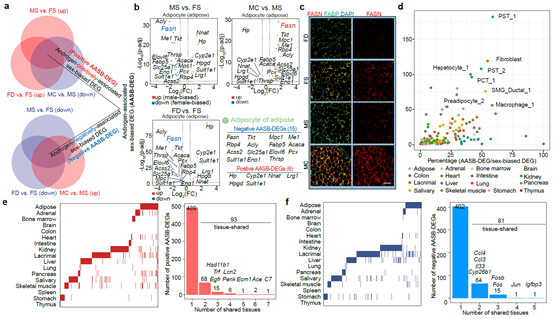
图2. 雄激素调控性别差异的分子基础
细胞组成对于机体的稳态维持和疾病发生发展至关重要。研究人员对17种器官中细胞组成进行了解析,基于此探究了雄激素调控性别差异的细胞基础。与分子水平的表型相一致,从整体上来看,无论是在雌鼠中添加雄激素还是在雄鼠中去除雄激素均能够显著减弱细胞比例上存在的性别差异。考虑到雄激素对于免疫器官大小和免疫分子表达具有调控作用,研究人员特异性分析了所有器官的免疫细胞组成,并且定义了其比例受雄激素调控且具有性别差异的免疫细胞类型(androgen-associated sex-biased immune cell type,AASB-immune cell type)。有趣的是,绝大多数雄激素所正向调控的AASB-immune cell type是髓系免疫细胞,包括嗜中性粒细胞和巨噬细胞,而受雄激素负向调控的AASB-immune cell type均是淋巴系免疫细胞,提示了雄激素在调控不同免疫应答中具有不同功能。在AASB-immune cell type中,研究人员注意到ILC2的比例在雌性小鼠中较高、添加雄激素后则降低、去除雄激素后则升高,且该表型在多个器官之间具有保守性。此外, ILC2在主要免疫细胞类型中具有最高的雄激素受体(androgen receptor,AR)表达水平,这也为雄激素直接作用于ILC2提供了分子基础(图3)。
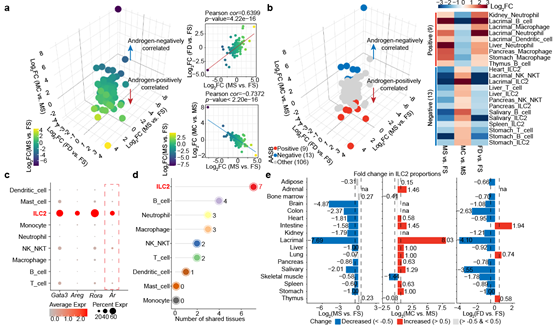
图3. 雄激素调控性别差异的细胞基础
研究人员基于构建的单细胞图谱对UK Biobank数据集中的性别差异性疾病与细胞类型进行了关联分析,鉴定了这些疾病的潜在细胞靶标。性别差异性疾病的潜在致病基因表现出了MHC分子的显著富集,提示了MHC分子在性别差异性疾病中的重要角色。研究人员发现雄激素能够在多种器官和细胞中调控MHC分子的表达水平,比如雄激素可以在脾脏的巨噬细胞中显著上调H2-Ab1的表达水平。值得一提的是,近期的两项研究表明雄激素通路抑制剂可以显著改善结肠癌对于抗PD-L1和黑色素瘤对于靶向BRAF/MEK的治疗响应3,4。这些发现进一步为通过靶向雄激素信号通路治疗性别差异性疾病提供了理论支撑(图4)。
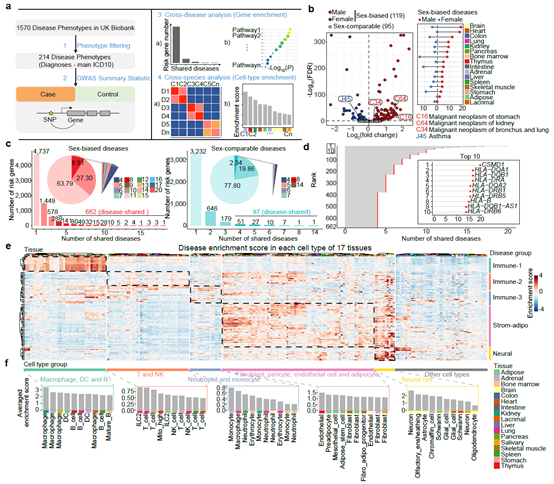
图4. 雄激素与性别差异性疾病的关联分析
综上,本研究系统性证明了雄激素在性别差异中扮演着重要角色,并深入解析了雄激素调控性别差异的分子和细胞基础,鉴定了雄激素对于免疫分子和免疫细胞的重要调控作用,为理解性别差异性疾病的发生发展机制和靶向雄激素信号通路的潜在临床应用提供了重要理论基础。
分子细胞卓越中心副研究员李飞、北京大学博士后邢旭东、分子细胞卓越中心博士后靳琪琪、北京大学博士后王湘铭、分子细胞卓越中心博士研究生戴鹏飞和韩铭为该论文共同第一作者。北京大学白凡教授、分子细胞卓越中心高栋研究员、分子细胞卓越中心陈洛南研究员、深圳湾实验室于晨研究员为该论文共同通讯作者。这项工作获得了国家自然科学基金、科技部、中国科学院、北京市和上海市的基金支持,也得到了腾讯科学探索奖的支持。
原文链接:https://www.nature.com/articles/s41586-024-07291-6
1 Mauvais-Jarvis, F. et al. Sex and gender: modifiers of health, disease, and medicine. Lancet 396, 565-582, doi:10.1016/S0140-6736(20)31561-0 (2020).
2 Khramtsova, E. A., Davis, L. K. & Stranger, B. E. The role of sex in the genomics of human complex traits. Nat Rev Genet 20, 173-190, doi:10.1038/s41576-018-0083-1 (2019).
3 Vellano, C. P. et al. Androgen receptor blockade promotes response to BRAF/MEK-targeted therapy. Nature 606, 797-803, doi:10.1038/s41586-022-04833-8 (2022).
4 Yang, C. et al. Androgen receptor-mediated CD8(+) T cell stemness programs drive sex differences in antitumor immunity. Immunity 55, 1-16, doi:10.1016/j.immuni.2022.05.012 (2022).