检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2019年12月24日,Cancer Research在线发表js3845金沙线路郑晓峰教授研究组的题为“The Deubiquitinase USP38 Promotes NHEJ Repair through Regulation of HDAC1 Activity and Regulates Cancer Cell Response to Genotoxic Insults” 的研究文章。该研究鉴定了一个在DNA损伤应答中发挥作用的新的去泛素化酶USP38。发现USP38通过去除去乙酰化酶HDAC1的泛素化修饰来抑制HDAC1的去乙酰化酶活性,进而调控DNA双链断裂主要修复途径之一的非同源末端连接修复(NHEJ)的修复效率,在细胞基因组稳定性维持中发挥重要作用。该研究揭示了去泛素化酶参与调控DNA损伤调控的新机制。
DNA损伤修复通路(DNA damage response pathway,DDR)在维持细胞基因组稳定性中发挥重要作用。DNA损伤修复受到泛素化等蛋白质翻译后修饰的严格而精细的调控,其中,去泛素化酶通过两种主要方式参与到DNA损伤修复过程中:直接作用到损伤位点或者调控DNA损伤应答关键的因子。鉴于DNA损伤应答调控的复杂性,鉴定新的参与到DNA损伤修复中的去泛素化酶,阐明其发挥作用的机制,有助于我们深入了解DDR修复的分子机制。
该研究通过激光微辐射和中彗星实验发现,去泛素化酶USP38能够被募集到DNA损伤位点,在细胞基因组稳定性的调控中至关重要。进一步研究发现,USP38可以去除去乙酰化酶HDAC1的K63位连接的多聚泛素化修饰,进而上调HDAC1的去乙酰化酶活性,去除H3K56的乙酰化修饰,提高NHEJ的修复效率。生信分析和免疫组化的研究结果表明,USP38在大多数种类肿瘤中具有低表达的现象。在肾癌细胞系和小鼠中,USP38的缺失都会导致基因组的不稳定性,并且导致细胞和小鼠对于DNA损伤刺激更为敏感。与野生型小鼠的高存活相反,USP38-/-小鼠在IR照射后20天内全部死亡,进一步证明USP38对于维持细胞的损伤修复效率和基因组稳定性是至关重要的。
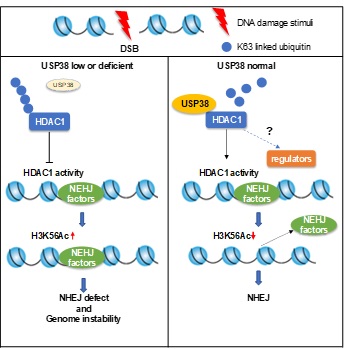
图. USP38通过调节HDAC1的泛素化修饰及其去乙酰化酶活性调控NHEJ和基因组稳定性
综上所述,这项研究揭示了去泛素化酶USP38参与DNA损伤应答的机制,进一步明确了泛素化修饰和乙酰化修饰之间的作用关系,阐明了USP38在维持基因组稳定性和调节肿瘤细胞对于放化疗敏感性的机制。
js3845金沙线路博士研究生杨永烽为该论文的第一作者,js3845金沙线路郑晓峰教授为该论文的通讯作者,中山大学js3845金沙线路崔隽教授、js3845金沙线路胡家志研究员及其博士生甘婷婷、北大生科院博士生杨传真、李亭亭和于书玉也在该课题中做出了重要贡献。这项研究得到了国家自然科学基金重点项目、蛋白质与植物基因研究国家重点实验室, 以及国家蛋白质中心凤凰工程和js3845金沙线路仪器中心的大力支持。
原文链接:https://cancerres.aacrjournals.org/content/early/2019/12/24/0008-5472.CAN-19-2149