检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
垂体是最重要最复杂的内分泌腺体之一,是内分泌信号转导的司令部,作为神经-内分泌系统中的主要成员,在维持机体内环境稳态中发挥关键作用。它位于大脑底部的蝶鞍中,重量不到1克,分为腺垂体和神经垂体两部分。腺垂体主要由五种激素细胞组成,包括生长激素细胞、催乳素细胞、促甲状腺素细胞、促肾上腺皮质激素细胞和促性腺激素细胞。这些细胞与下游靶内分泌腺之间构成复杂的信号系统,在生长发育、代谢调节、生殖以及应激等生理过程中发挥重要作用。垂体发育是一个精妙的过程。在人类胚胎第3周左右,腹侧间脑与原始口腔顶部外胚层接触,诱导其内陷形成一个微型囊状结构(Rathke囊),囊壁细胞通过分裂、迁移和分化,最终形成各种激素细胞类型。过去近三十年的小鼠遗传学研究已鉴定出许多信号途径(如BMP、FGF、WNT和SHH)和转录因子(如LHX3/4、PITX1/2、PAX6、HESX1、SOX2、PROP1、POU1F1(PIT-1)、GATA2、TBX19(TPIT)和NR5A1(SF-1))参与了垂体发育 ADDIN EN.CITE ADDIN EN.CITE.DATA 1-4。然而,我们对垂体发育过程所经历的各种细胞状态及其动态变化知之甚少;我们甚至缺乏对这些激素细胞类型或亚型基因表达谱的准确认知——因为常规转录组方法需要上万个细胞,检测到实际上是各种激素细胞类型的“平均细胞”。
js3845金沙线路、生物医学前沿创新中心(BIOPIC)与北京大学第三医院合作,于2020年10月19日在国际知名学术期刊《Nature Communications》上在线发表了题为“Single-cell transcriptomics identifies divergent developmental lineage trajectories during human pituitary development”的文章。该研究利用单细胞转录组测序技术,揭示了7周至25周人类胚胎垂体中五种主要激素细胞的发育轨迹,定义了中间过渡细胞类型并发现了一个新的灵长类特异的促性腺激素细胞亚类,并阐明了垂体干细胞的状态变迁。

首先,研究人员对分子特征尚未研究清楚的人类垂体干细胞进行亚群特征鉴定,发现干细胞亚群随发育时间变化,早期干细胞增殖能力较强,且高表达垂体所有激素细胞分化必需的转录因子ASCL1,该基因对于早期干细胞分化可能发挥了重要作用。晚期干细胞增殖能力被抑制,且高表达WNT信号调节因子SFRP2和WNT5A。此外,相较于已分化的激素细胞,垂体干细胞同时高表达上皮的标志基因CDH1与间充质的标志基因VIM和CDH2,即处于混合上皮/间充质(hybrid E/M)状态,且与干性状态正相关,之前的研究表明该混合状态在小鼠器官发生和肿瘤转移中也发挥了重要作用5。
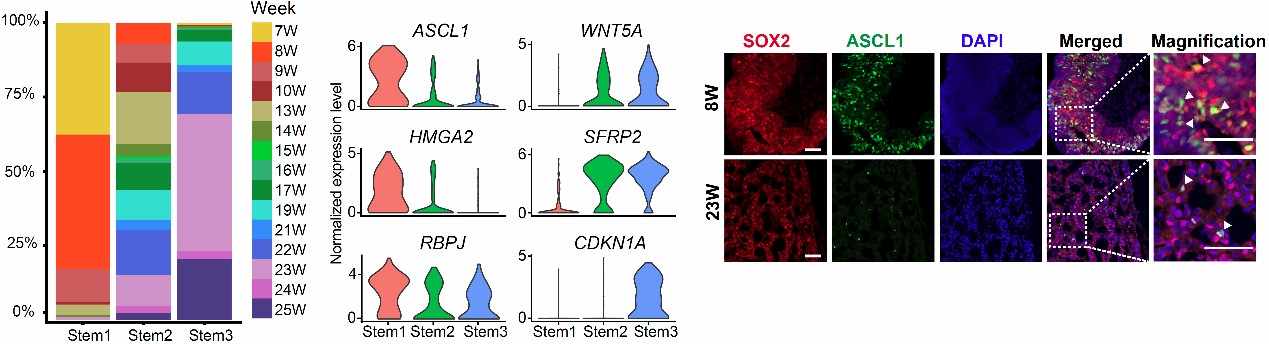
图1 干细胞亚群分布及特异表达的转录因子
随后,利用拟时间分析RNA velocity和Slingshot生物信息学方法,研究人员绘制了五种激素细胞的谱系发育路径和分化方向,鉴定出谱系共享或谱系特异的下调或上调的转录因子,其中一些转录因子在中间态就已经上调,对细胞命运决定起到关键的调控。
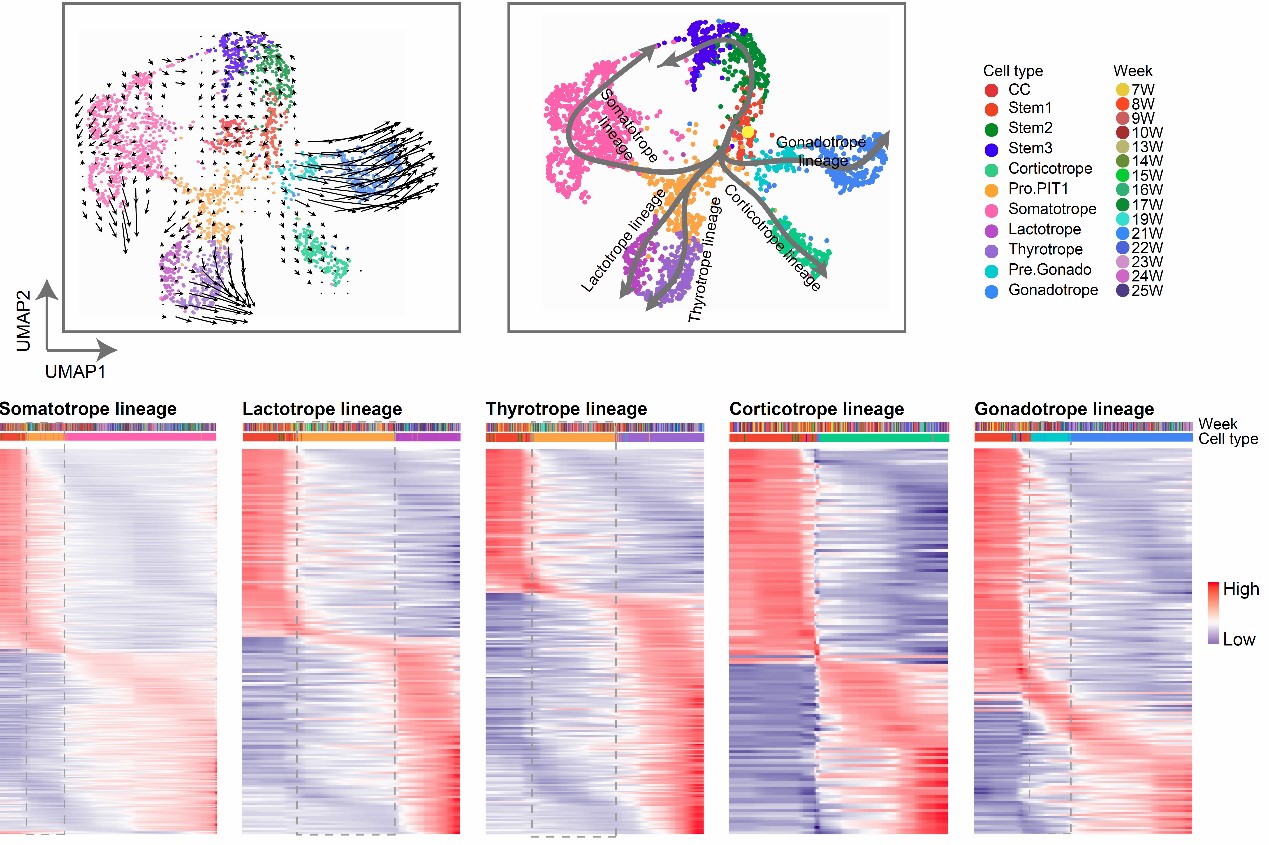
图2 垂体内分泌细胞的拟时间发育轨迹及各谱系转录因子的动态变化
然后,研究人员对五种激素细胞谱系分别进行详细分析。发现促肾上腺皮质激素细胞从早期的具有少量的增殖细胞的中间状态,逐渐发育成熟并建立皮质醇反馈通路。PIT-1谱系包括三种激素细胞类型:生长激素细胞、催乳素细胞和促甲状腺激素细胞,拟时间分析鉴定出他们的共同祖细胞Pro.PIT1_all,GATA2阳性的促甲状腺激素细胞前体Pre.Thy和潜在的促生长激素细胞前体Pre.Som。PIT-1各个谱系特异的关键转录因子NEUROD4、ZBTB20、ASCL1在Pro.PIT1_all均相较干细胞表达上调,祖细胞进一步分化为NEUROD4high/ZBTB20mid/ASCL1low 促生长激素前体和成熟细胞, NEUROD4mid/ZBTB20high/ASCL1low 催乳素细胞以及NEUROD4low/ZBTB20mid /ASCL1high 促甲状腺激素前体和成熟细胞,表明祖细胞在细胞命运决定之前有共同激活的程序,结合小鼠双敲模型推测ZBTB20在催乳素细胞分化中与另外两个转录因子存在竞争关系6。促性腺激素细胞呈现出起始时间不同的两个发育轨迹,其中表达灵长类特有的绒毛膜促性腺激素(CGB)的谱系起始于早期,对人类早期下丘脑 -垂体 -性腺轴 (HPG轴)的发育可能具有关键调控作用,而小鼠模型中并没有表达CGB的细胞亚型;高表达促卵泡激素(FSH)的亚型则起始于晚期。
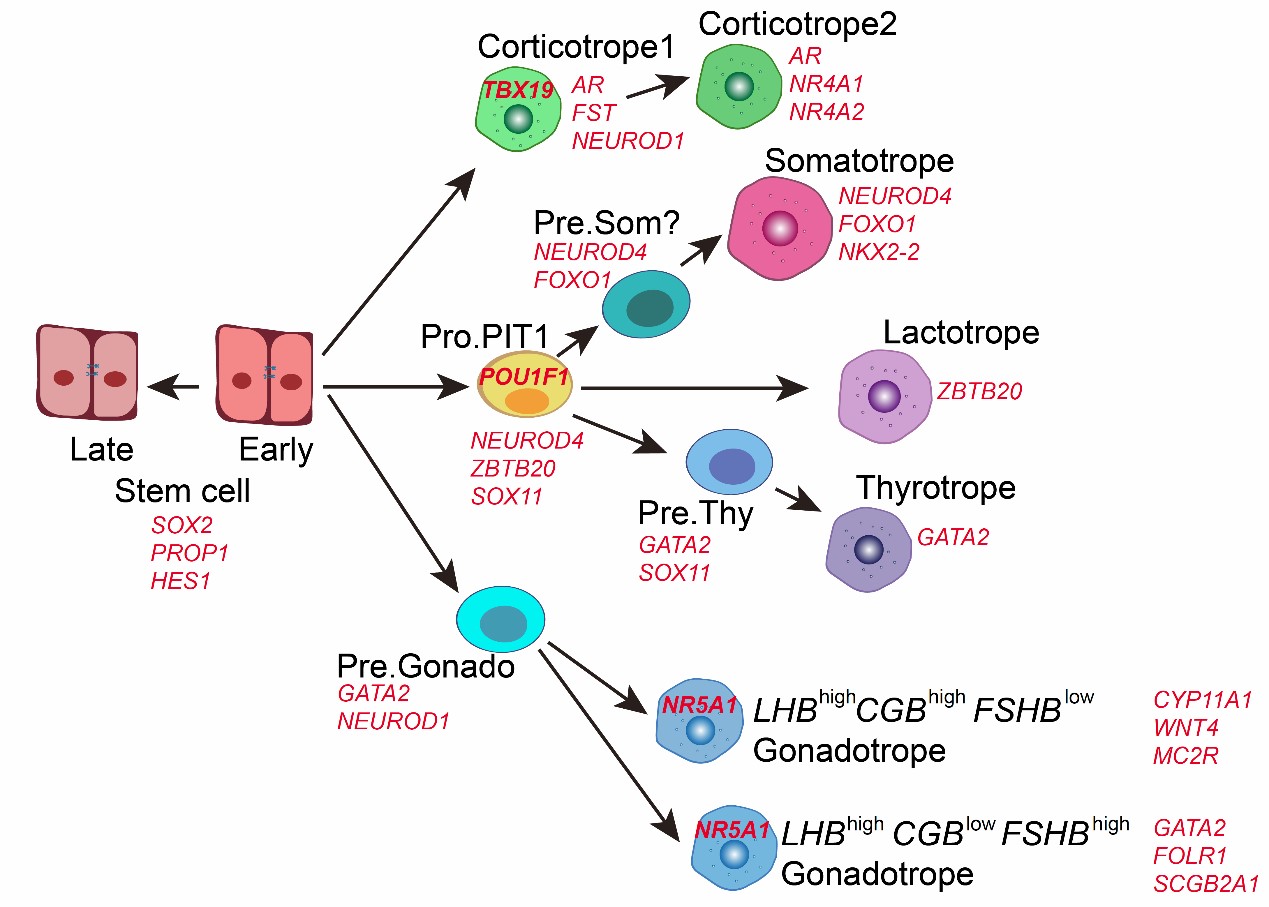
图3 人类垂体发育的模式图
综上所述,这项研究绘制了首张人类垂体发育和胎儿垂体激素细胞单细胞转录组图谱,有助于寻找新的先天性垂体疾病致病基因,也为探索垂体功能低下的干细胞治疗提供了参照。
北京大学生物医学前沿创新中心博士后张书、博士研究生崔月利和北京大学第三医院生殖医学中心博士研究生马昕怡为本文并列第一作者。生物医学前沿创新中心副研究员文路和北京大学第三医院乔杰教授为本文共同通讯作者。该研究项目得到了国家重点研发计划、国家自然科学基金和北京未来基因诊断高精尖创新中心(ICG)的支持。
参考文献
1 Zhu, X., Gleiberman, A. S. & Rosenfeld, M. G. Molecular physiology of pituitary development: signaling and transcriptional networks. Physiol Rev 87, 933-963, doi:10.1152/physrev.00006.2006 (2007).
2 Li, S. et al. Dwarf locus mutants lacking three pituitary cell types result from mutations in the POU-domain gene pit-1. Nature 347, 528-533, doi:10.1038/347528a0 (1990).
3 Lamolet, B. et al. A Pituitary Cell-Restricted T Box Factor, Tpit, Activates POMC Transcription in Cooperation with Pitx Homeoproteins. Cell 104, 849 (2001).
4 Zhao, L. P. et al. Steroidogenic factor 1 (SF1) is essential for pituitary gonadotrope function. Development 128, 147-154 (2001).
5 Vieira, A. F. & Paredes, J. P-cadherin and the journey to cancer metastasis. Mol Cancer 14, 178, doi:10.1186/s12943-015-0448-4 (2015).
6 Ando, M. et al. The proneural bHLH genes Mash1, Math3 and NeuroD are required for pituitary development. J Mol Endocrinol 61, 127-138, doi:10.1530/JME-18-0090 (2018).