检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2020年12月22日,js3845金沙线路张传茂教授实验室在国际知名细胞生物学杂志Journal of Cell Biology以长文形式在线发表了题为“PLK4-phosphorylated NEDD1 facilitates cartwheel assembly and centriole biogenesis initiations”(https://rupress.org/jcb/article-abstract/220/1/e202002151/211633/PLK4-phosphorylated-NEDD1-facilitates-cartwheel?redirectedFrom=fulltext)的研究论文。该项工作发现,中心粒外周基质蛋白(PCM)的组分之一NEDD1对于车轮结构装配和中心粒发生的起始至关重要,并且这个过程受到了PLK4激酶的磷酸化调控,该项工作明确了车轮结构装配起始的精确位置并阐明了其具体的调控机制。

中心体是广泛存在于真核细胞中具有致密结构的细胞器,它是细胞内最大的微管组织中心,介导双击纺锤体的建立并确保遗传物质的平均分配。中心体是由两个中心粒以及包裹在外周的中心粒外周基质(PCM)组成。随着超高分辨率显微镜技术的发展,通过免疫荧光标记PCM蛋白组分,人们发现中心粒外周基质在母中心粒外周的排列是有序的,即由内向外呈同心圆方式环绕在中心粒外周。然而间期这么高度有序排列的中心粒外周基质PCM与中心体复制起始的关系尚不清楚;车轮结构的装配代表新中心粒形成的第一步,车轮结构组装和原中心粒的发生是如何起始的以及起始位置在哪里,都有待研究。
在本项工作中,该团队发现NEDD1蛋白的缺失严重破坏了车轮结构装配和子中心粒发生的起始。在正常情况下,PCM的分层结构是受到严格调控的,PCM蛋白被顺序招募到中心体上,Cep192呈环状分布,PCNT呈放射状分布,它们两个协同招募了NEDD1以环状的形式定位在中心体上,从而使NEDD1可以与PLK4在G1期共定位,而NEDD1蛋白招募了γ-TuRC到PCM上。进一步地,通过超高分辨率显微镜观察发现NEDD1作为一个基座协助起始了车轮结构的装配和子中心粒的发生。
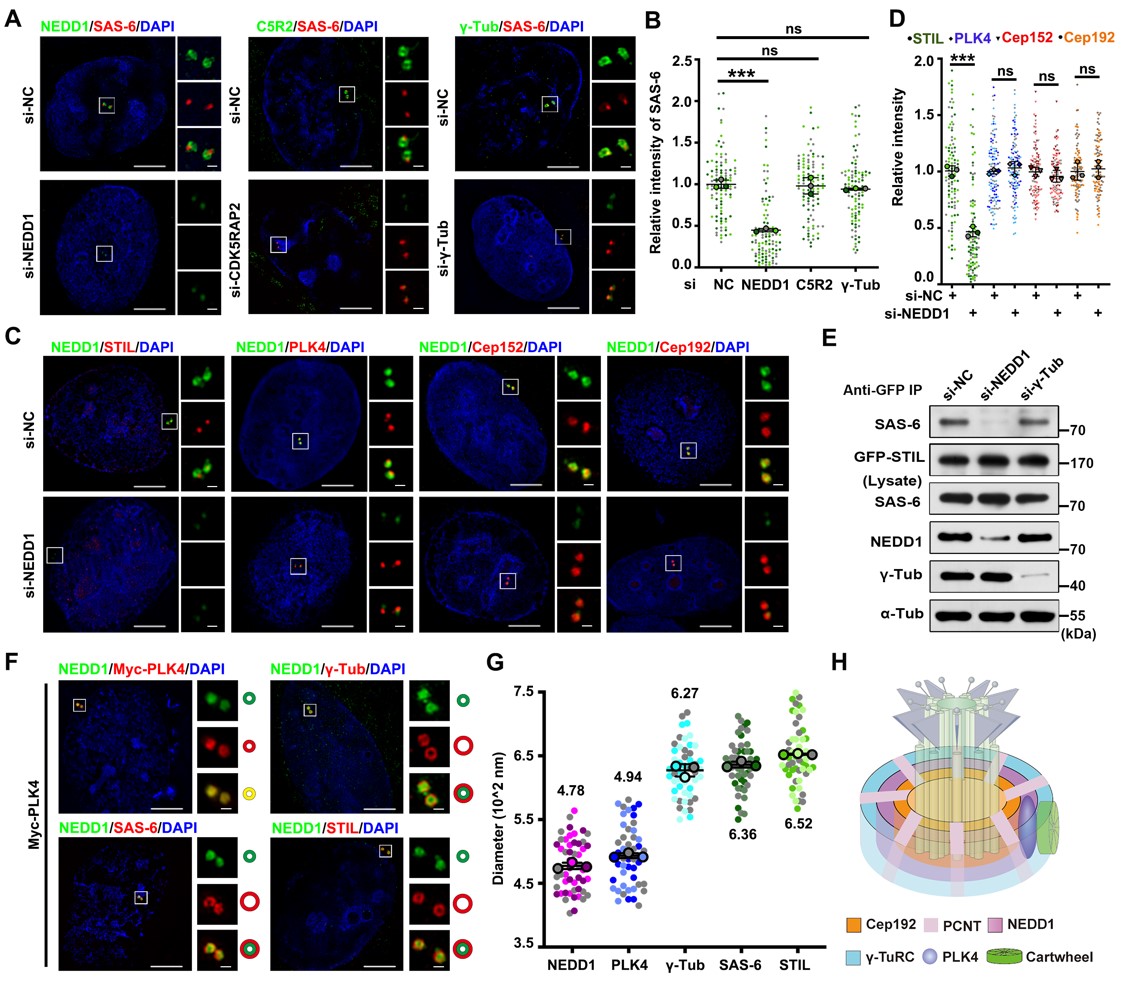
车轮结构在PCM组分之一NEDD1层上起始装配
通过免疫荧光,免疫共沉淀和体外蛋白质结合实验表明,NEDD1与车轮结构的核心组分SAS-6之间存在直接的相互作用。并且二者的相互作用受到了细胞周期的调控,二者结合的时期也恰好是中心体复制起始发生的时期,即S期早期,从而证实了NEDD1可以通过将SAS-6直接招募到中心体上来起始车轮结构的装配。
进一步地,该团队发现NEDD1协助起始车轮结构装配的过程受到了PLK4激酶的磷酸化调控。进入S期后,PLK4 激酶的活化,使NEDD1在S325位点发生了磷酸化从而使车轮结构的装配可以在NEDD1这一层上起始,具体过程是磷酸化的NEDD1与γ-TuRC的结合减弱,而与SAS-6发生相互作用将SAS-6招募到中心体上,与STIL蛋白一起装配车轮结构。随着细胞周期的进行,PLK4激酶活性减弱,NEDD1与γ-TuRC的相互作用增强,使NEDD1可以结合更多的γ-TuRC组分来成核中心粒微管,从而起始子中心粒的形成。而如果引起NEDD1的过度磷酸化,会使过多的SAS-6被招募到中心体而导致中心粒的过度扩增,甚至引起多级纺锤体的产生进而导致染色体分离异常。综上所述,该项工作阐明了NEDD1协助起始车轮结构装配和中心粒发生的具体机制,为理解中心体循环与细胞周期调控相偶联的潜在机制提供了重要信息。
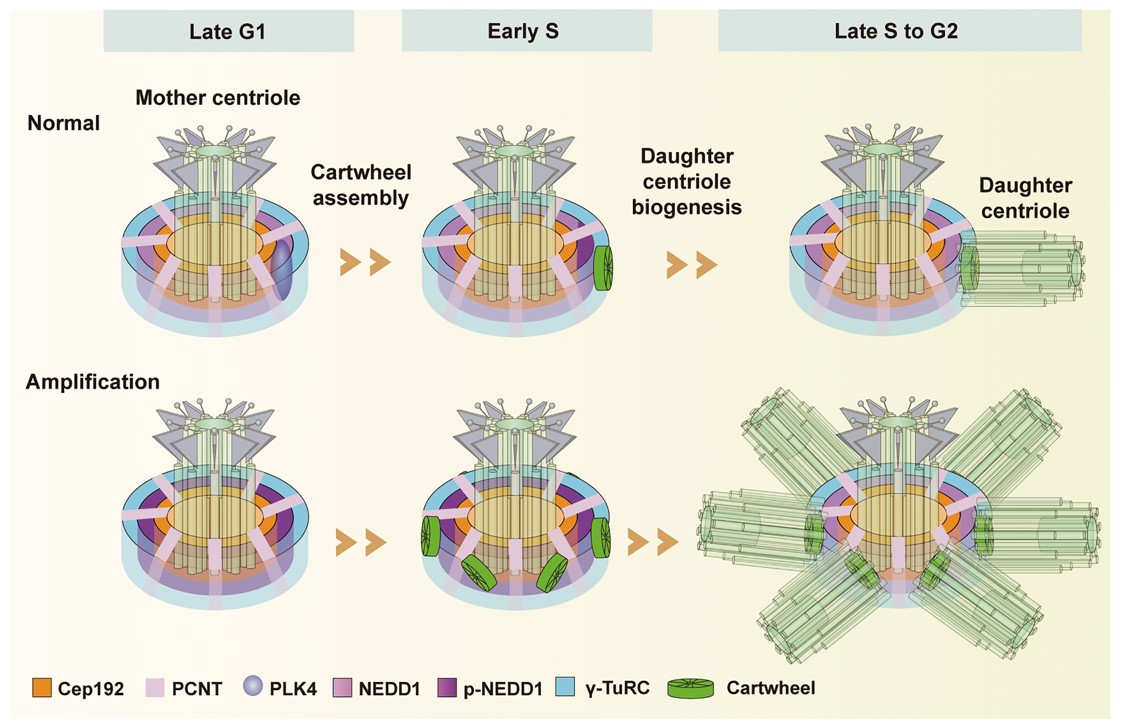
NEDD1 在PLK4激酶的调控下协助起始车轮结构的装配和子中心粒的发生
js3845金沙线路张传茂教授为本论文的通讯作者,张传茂实验室博士研究生迟王菲为本论文第一作者,实验室多位老师对此项工作做出了贡献。该项目受到国家自然科学基金委员会和科技部的项目资助。
张传茂教授实验室长期以来主要以细胞生物学、分子生物学和生物化学方法技术等为研究手段,以培养细胞,小鼠、非洲爪蟾、果蝇等为主要实验材料,在分子、亚细胞、细胞、组织和个体水平上,从事干细胞增殖与分化、细胞周期调控(包括纺锤体装配和核膜装配机理等)、细胞核结构、细胞核动态变化及功能、Ran GTP酶功能调控、肿瘤细胞增殖调控等方面的研究。